做这篇笔记的起因:看《Neuroscience: Exploring the Brain》的Chapter3 讲到水的极性使得一个良好的溶剂,其他带电的或极性分子易溶于水。大学化学没学好,高中化学早忘光了,简单补一补关于离子键、共价键、极性、氢键的知识。查完资料,表示日常见的水原来这么神奇,非常惊叹!
我们地球的70%是海水,我们身体的65%是由水组成的,很难不意识到它在我们生活中的重要性。这个简单的事实就是为什么科学家们不断地在其他星球上寻找水——水的存在可能表明生命的存在。
水虽然被认为是生命之源,但它身上有很多奇异甚至反常之处,比如固态的水(冰)密度比液态的水还小(所以冰块才会浮在水面上),比如水几乎是最难以被压缩的液体。这一切都和水独特的分子结构有关
水的极性与氢键
水的分子结构很简单,H2O,它由一个氧原子和两个氢原子组成。每个氢原子通过一对共享的电子与氧共价键合,同时氧也有两对不共享的电子。因此,氧原子周围有4对电子,两对电子与氢形成共价键,两对电子位于氧原子的另一面。与氢相比,氧的电负性比氢高,即更容易吸引电子。于是水分子的电子密度分布不均匀,由于不共享的电子对,水在氧原子附近有部分负电荷(δ - ),在氢原子附近有部分正电荷(δ + )。
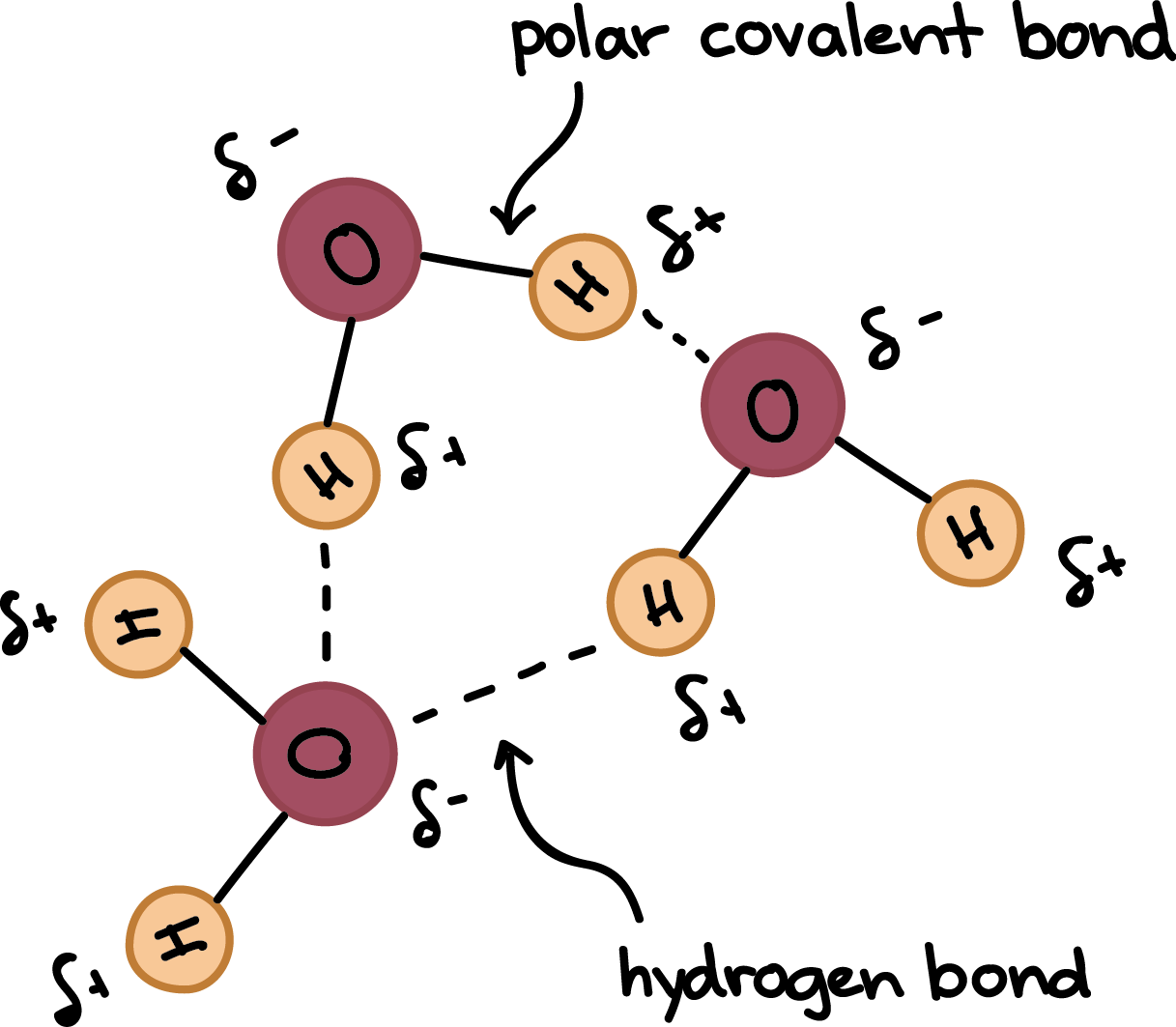
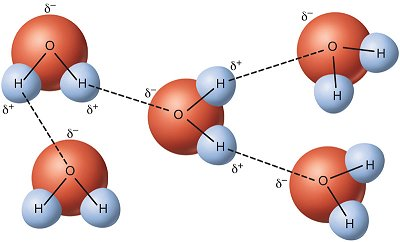
氢原子附近的部分正电荷和氧原子附近的部分负电荷之间的静电吸引导致水分子互相吸引,同时亦使它们和其他极性分子互相吸引。这种吸引力被称为氢键。水的极性和氢键解释了许多水的特性:
- 离子和其他分子溶于水的能力是由于极性
- 冰漂浮是因为氢键使水分子在固体中比在液体中相距更远,在液体中每个分子少一个氢键
- 水独特的物理性质,包括高沸点、强表面张力、高比热和几乎通用的溶剂性质也是由于氢键
溶剂:万能溶剂
水被称为万能溶剂,因为溶解在水中的物质比溶解在任何其他化学物质中的物质都多。这与每个水分子的极性有关。
每个水分子的氢侧携带轻微的正电荷,而氧侧携带轻微的负电荷。这有助于水将离子化合物分解(分离)成它们的正离子和负离子。离子化合物的正部分被水的氧侧吸引,而化合物的负部分被水的氢侧吸引。
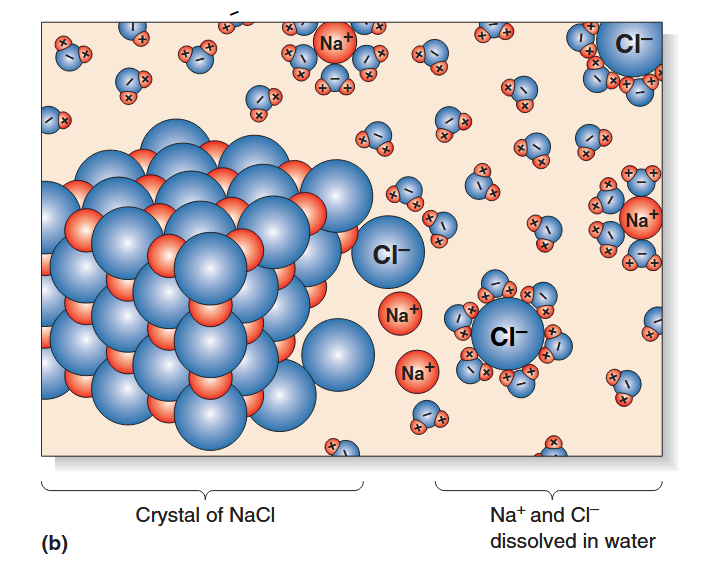
水的溶解性对于细胞内的化学反应和分子运输至关重要。
离子化合物、极性分子(如葡萄糖和氨基酸)可以与水分子相互作用,并溶解在水中,容易与水相互作用或溶解在水中的极性物质被称为亲水性物质hydrophilic (hydro- = “water”; -philic = “loving”)。但水对非极性物质如脂肪和烃类物质的溶解能力较弱,这些非极性化合物被称为疏水性化合物hydrophobic (hydro- = “water”; -phobic = “fearing”)。
水在细胞内和生物体中用作运输介质。极性分子通常通过水的溶解来传输,例如,营养物质和废物。
由于水分子的极性特性,非极性物质在水中往往不能与水分子相互作用,因此它们倾向于聚集在一起,减少与水分子的接触。这种现象被称为疏水作用。
疏水作用在生物体中起着重要的作用,例如脂肪酸和磷脂等疏水性分子在细胞膜的形成和稳定中发挥着关键的作用。由于脂质分子的疏水性,它们在水中会自发地聚集在一起,使疏水性的烃尾部相互接触,从而减少与水分子的接触。这种自组装过程形成了脂质双层结构,其中疏水性的烃尾部朝向内部,亲水性的磷酸头部朝向外部与水分子相互作用。疏水作用使脂质双层紧密结合,形成了细胞膜的基本结构。疏水作用的强大使得细胞膜能够自发地形成,并保持其稳定性。这种稳定性是细胞膜在维持细胞内外环境差异、调节物质的进出等生物学功能中至关重要的。
密度:热胀冷也胀
密度是质量与体积的比率,密度较大的物体容易下沉,而密度较小的物体容易漂浮。大多数物体的密度随着温度的变化而略有变化。一般来说,温度越高,物质的密度越小,因为更大的随机动能会使分子散开。物体受热时膨胀的量称为膨胀系数。
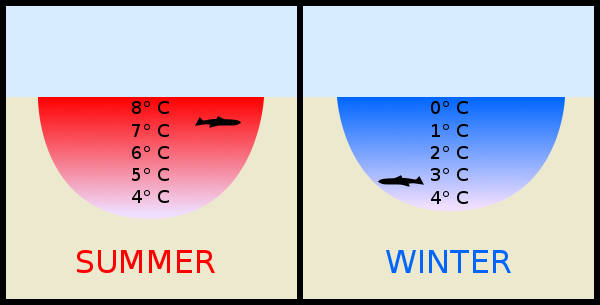
水的密度又是一个特例。水在3.98°C时密度最大,当它从这个温度冷却或变暖时,水会轻微膨胀,热胀冷也胀。
这意味着冰的密度比冷水稍小,这就是冰漂浮在水体表面的原因。水是少数固态能浮在液态上的物质之一!
在冰的结构中,每个氧原子与4个氢原子相连接而成四面体,每个氢原子与两个氧原子相连结。即氧原子的四个键(两个共价键,两个氢键),指向一个四面体的四个顶点,每个水分子都被四个水分子所包围。但冰是一种很不紧凑的结构,这种四面体结构对空间的利用率较低,只有34%。当冰熔解时,一些氢键被破坏,四面体结构被瓦解,水分子可以比较紧密地堆积在一起,因此,冰在熔解时体积要缩小。因此冰比水疏松,密度只有水的0.9倍。
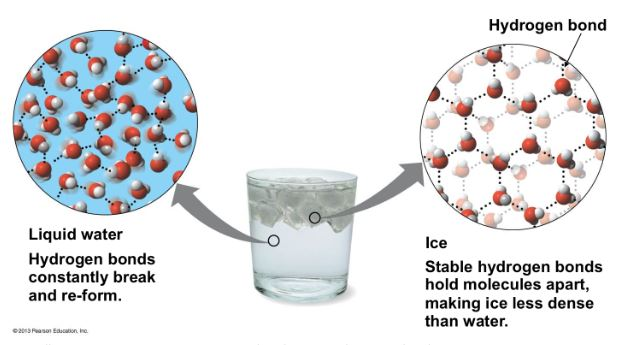
从生态学意义上来看,浮冰通过隔离下面的水来减缓冻结过程,最冷的水在上方,湖泊底的水依然有4℃,保护水下的生物免受极端寒冷的影响。如果冰不能漂浮,湖水将自下而上冻结,杀死湖中所有的生态系统!
沸点和冰点
尽管分子量很小,但它的沸点却高得令人难以置信(100摄氏度)。这是因为水在开始沸腾之前需要更多的能量来打破氢键。同样的概念也适用于冰点,水的冰点也比较高,这是由于冰的晶体结构中的水分子排列相对稳定,需要较高的能量才能破坏这种结构,所以水的冰点较高。水的沸点和冰点使分子能够非常缓慢地沸腾或冻结,这对生活在水中的生态系统非常重要。如果水很容易结冰或沸腾,环境的剧烈变化会影响水体,如海洋或湖泊,并导致所有生活在水中的生物死亡。
水和其他化合物的沸点冰点比较
化合物 沸点(摄氏度) 冰点(摄氏度) 水(H2O) 100 0 乙醇(C2H5OH) 78.5 -114 甲烷(CH4) -161.5 -182.5 氨(NH3) -33.3 -77.7 氯化氢(HCl) -85.1 -114.2
比热容
比热容是将一克物质的温度升高一摄氏度所需的热量。每种物质都有自己的比热容,水的比热容为1 cal/(g℃)。
水的比热容远高于其他普通物质。为了便于比较,油的比热容约为0.5cal/(g℃),铝的比热容约为0.2 cal/(g℃)。这意味着,与提高油或铝的温度相比,提高水的温度需要更多的热量。
水的高比热有助于地球温度保持适中,因为水在白天吸收热量,在晚上缓慢释放热量。因此,地球表面的温度变化不大,从56.7 °C到−89.2 °C不等。相比之下,月球没有液态水,其温度范围从150 °C 到-180°C。(月球上缺乏大气层,以及其他因素,也是造成温度范围大的原因之一。)
表面张力
除了水银,由于水具有所有非金属液体中最大的表面张力值72.8 mN/m(20℃),使水滴保持相对稳定。
表面张力是液体表面的一种特性,由于其分子的内聚力,这种特性使液体能够抵抗外力。在水中,氧原子的部分负电荷会与其他水分子的部分正电荷形成氢键。这种氢键的形成导致水分子之间存在相互吸引的力量,即内聚力,使得水分子倾向于聚集在一起。这种聚集现象使得水在表面形成一个紧密的分子层,从而形成表面张力。
表面张力是在水面上破皮所需的力的量度。其他液体也有表面张力,但由于氢键,水中的表面张力相当强。于是杯子里的水位实际上比杯子的高度要高依然不溢出、一些昆虫可以直接在水上行走、露水呈球形。

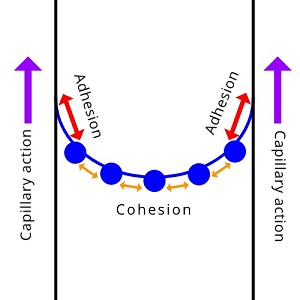
毛细作用
没有毛细作用,植物和树木就无法茁壮成长。它有助于将水分带到根部。在附着力和内聚力的帮助下,水可以一路流到树枝和树叶上。
毛细作用是液体在细管状物体或多孔物体内部,由“液体与物体间附着力”和“因液体分子间内聚力而产生的表面张力”组合而成,令液体在不需施加外力的情况下,流向细管状物体或细缝的现象
毛细作用的发生是因为水是粘性的,这要归功于内聚力cohesion(水分子喜欢靠得很近)和附着力adhesion(水分子被吸引并粘在其他物质上)。水粘附在容器壁上会在边缘对液体产生向上的力,当与壁的粘附力强于液体分子之间的内聚力时,就会发生毛细作用,水面克服重力上升的现象。